
Genomsequenzierung.
Umfassende Charakterisierung.
Zielführende Therapie.
Je mehr Information man über die Tumorerkrankung, aber auch den genetischen Hintergrund des Patienten weiß, umso effizienter mag eine gezielte Therapie in Zukunft möglich werden. Dazu gehört eine umfassende Diagnostik, methodisch auf dem neuesten Stand der Technik, aber auch ein patientenorientierter Umgang und Nutzen dieser Daten.
Genomsequenzierung
Das Whole Genome Sequencing (WGS) erlaubt, die komplette Erbinformation eines Menschen zu lesen, die gutartigen Polymorphismen zu erkennen und somatische Mutationen, die in der Krebsdiagnostik eine wichtige Rolle spielen, zu identifizieren. Mit nur einem methodischen Ansatz lassen sich sämtliche Veränderungen des Tumors detektieren, neben Einzelbasenaustauschen (Single Nucleotide Variants, SNV) können durch WGS auch Zugewinne und Verluste (Copy Number Variations, CNV) und Translokationen (Structural Variation, SV) von chromosomalem Material detektiert werden. Aber nicht nur krankheitsassoziierten Mutationen, sondern auch prädiktive Marker, die ein Ansprechen auf eine Therapie hervorsagen, sind von Interesse. Je mehr Information man über die Tumorerkrankung, aber auch den genetischen Hintergrund des Patienten weiß, umso effizienter mag eine gezielte Therapie in Zukunft möglich werden. Zur Vorbereitung der Sequenzierung wird die DNA der Probe fragmentiert und mit patientenspezifischen Barcodes versehen, sodass jede einzelne gelesene Sequenz einer Probe zugeordnet werden kann. Die vorbereiteten Libraries werden mit einer Lesetiefe von 90x sequenziert, um auch kleine Zellklone detektieren zu können, die in der Tumorbiologie relevant sind. Die größte Herausforderung der Ganzgenomsequenzierung besteht aber sowohl in der bioinformatischen Prozessierung als auch der Interpretation der Daten. Hier werden zum einen große Arbeitsspeicher und Prozessoren benötigt, zum anderen geeignete Auswerte Pipelines, die die Unterscheidung zwischen benignen und pathogenen Veränderungen unterstützen.
- Knochenmark
- Peripheres Blut
bis zu 3 Wochen
Transkriptomanalyse
Obwohl jede Zelle des Körpers das identische Genom trägt, unterscheiden sich die Zellen je nach ihrer Funktion in ihrem Transkriptom (Gesamtheit der zellulären RNA). Bei der RNA Sequenzierung (Whole Transcriptome Sequencing, WTS) geht es um die Analyse des Transkriptoms, also der quantitativen Bestimmung der in einer Zelle vorliegenden transkribierten Gene. In einer z.B. durch Krebs veränderten Zelle kommt es zu einer abnormalen Genexpression, die durch die RNA Sequenzierung detektiert werden kann. Neben der Genexpression können auch Fusionstranskripte identifiziert werden, welche das Resultat struktureller Veränderungen (Translokationen von chromosomalem Material) sind. Zur Vorbereitung der Sequenzierung wird die RNA fragmentiert, ribosomale RNA entfernt, proteinkodierende RNA angereichert, die RNA in cDNA umgeschrieben, eindeutig identifizierbare Indices ligiert, welche es ermöglichen ein Sample von einem anderen zu unterscheiden, und abschließend des Materials mittels PCR angereichert. Die so vorbereitete Library wird dann sequenziert. Um eine ausreichende Genauigkeit bei der Transkriptomanalyse zu erreichen, werden 50 Millionen Reads (sequenzierte Fragmente) pro Probe angestrebt. Es folgt eine bioinformatische Verarbeitung der Daten um die Transkriptmenge pro Gen als auch die Fusionstranskripte zu detektieren. Basierend auf der Expression einzelner Gene kann ein umfangreiches Expressionsprofil erstellt werden, das für manche Erkrankungen oder Subtypen einer Erkrankung (wie der ALL) sehr spezifisch ist und zur Diagnostik beiträgt.
- Knochenmark
- Peripheres Blut
bis zu 3 Wochen
Molekulares Tumorboard
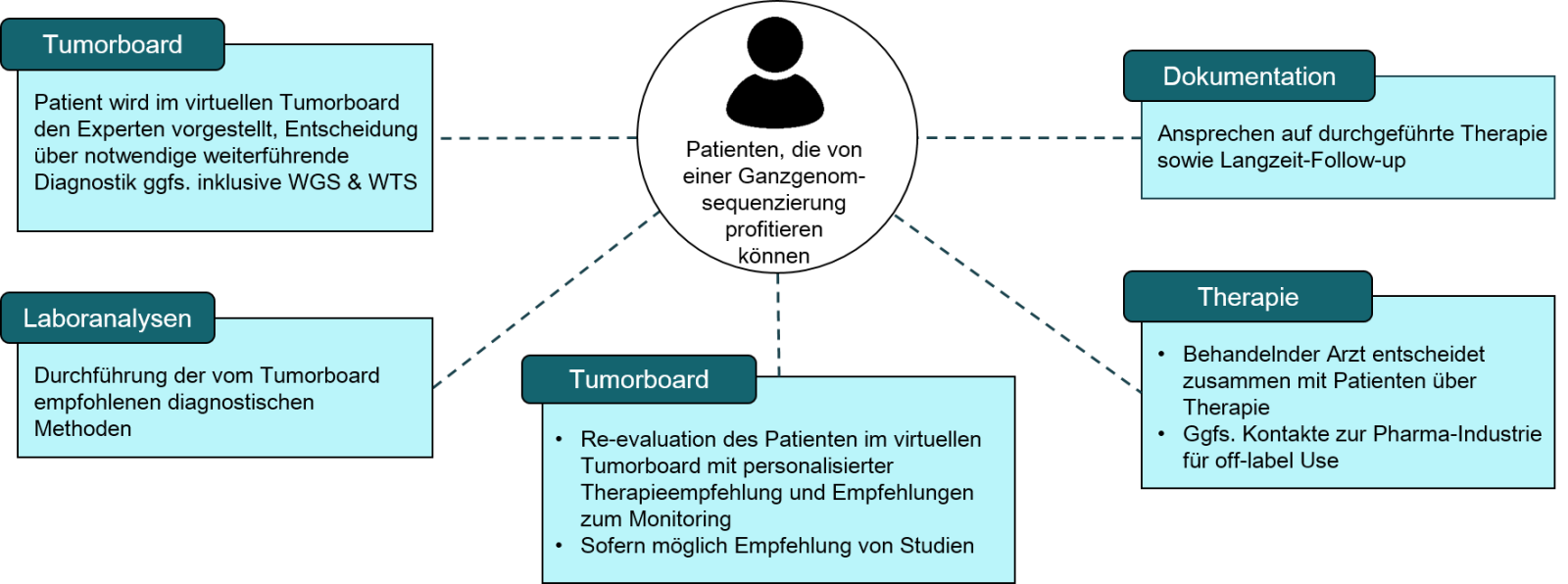
Mitglieder des Genomnetzwerkes Hämatologie können im Rahmen eines virtuellen molekularen Tumorboards den Experten des Genomnetzwerkes Hämatologie Patienten vorstellen, die aus ihrer Sicht eine umfassende Diagnostik z.B. WGS und WTS für den potentiellen Einsatz zielgerichteter Therapien benötigen. In dem dargestellten Prozess entscheiden die Experten über die geeigneten diagnostischen Methoden und informieren über geeignete laufende Studien für die der Patient potentiell qualifiziert. Die Termine an denen Molekulare Tumorboards stattfinden, finden Sie unter Veranstaltungen.
Messung der Resterkrankung (MRD)
Der Erfolg einer Therapie, das Therapieansprechen lässt sich durch die „Messbare Resterkrankung“ (measurable residual disease, MRD) bestimmen. Der Begriff beschreibt die im Verlauf oder nach Therapieende nachweisbare maligne Zellpopulation. Dazu werden diagnostisch hoch-sensitive Methoden wie quantitative PCR oder der zytometrische Nachweis einer Zellpopulation (Multicolor Flow Cytometry - MFC) verwendet. Damit kann eine maligne Zelle in 10.000 oder gar 100.000 Zellen nachgewiesen werden (Sensitivität: 0,01-0,001%). Insbesondere bei Patienten mit akuten Leukämien (AML und ALL) und lymphoproliferativen Erkrankungen gewinnt die klinische Diagnostik der MRD zunehmend an Bedeutung. Neben dem Therapieansprechen kann auch ein Rezidiv früh erkannt werden.
- Knochenmark
- Peripheres Blut
1 bis 7 Tage
Single-Cell Sequencing
Die Single-Cell Sequenzierung analysiert tausende Einzelzellen gleichzeitig und erfasst dabei die Diversität der einzelnen Zellzustände innerhalb einer Tumor-Probe. Verschiedene Techniken werden dabei unter dem Begriff vereint, u.a.: Analyse der Einzelzell-Genexpression, Einzelzell-ATAC oder Bestimmung des Einzelzell-Immunprofils. Bioinformatisch können die verschiedenen Datenebenen auch zu Einzelzell-Multiomics-Analysen kombiniert werden. Zur Vorbereitung der Sequenzierung werden die einzelnen Zellen oder Zellkerne isoliert und kodiert, es folgt die Library Vorbereitung für die zu untersuchenden Komponenten der Zellen (DNA, RNA, Protein) und anschließend die Sequenzierung. Die Methode wird aktuell in der Forschung gern eingesetzt um die Heterogenität eines Tumors durch Analyse der Einzelzellen zu untersuchen bzw. zu berücksichtigen.
- Knochenmark
- Peripheres Blut
nur in Projekten
Drug Screening
Ein zelluläres Drug Screening zielt darauf ab, in situ das Ansprechen auf eine spezifische Substanz oder die Kombination von Wirkstoffen für jeden Patienten individuell zu testen. Dabei werden die Blut- oder Knochenmarkzellen des Patienten kultiviert und im Hochdurchsatz mit Bibliotheken an Substanzen und Substanzkombinationen inkubiert, um so auf die apoptotische Wirkung zu testen. Dabei wird die Wirkung sowohl auf die gesunden als auch die Tumorzellen berücksichtigt. So können erste Hinweise auf das Ansprechen als auch Verträglichkeit verschiedener Therapien auf den individuellen Patienten untersucht werden. Durch verschiedene Kombinationstherapien bzw. Dosen kann eine Therapie entsprechend optimal an den Patienten angepasst werden. Da es sich hier um eine Methode handelt, die sich in der Entwicklung befindet, wird diese aktuell nur in der Forschung bzw. in Projekten angewandt.
- Knochenmark
- Peripheres Blut
nur in Projekten